Cómo se ordenan los elementos dentro de la tabla periódica
La tabla periódica es una de las mayores creaciones de la Química moderna. Su objetivo es poner orden y dar sentido a todos los elementos que encontramos en el universo.

Una pregunta habitual cuando hablamos de la tabla periódica, suele ser: «¿Cómo se clasificaban los elementos antes de que se desarrollara la tabla periódica?». La cuestión es que los elementos químicos han interesado a los científicos durante muchos siglos, pero hubo que esperar a principios del siglo XIX para que el estudio de los elementos y su clasificación tuviera grandes avances.
Antecedentes de la tabla periódica
El primer químico en llegar a la conclusión de que era necesario agrupar y clasificar los diferentes elementos fue el alemán Johann Wolfgang Döbereiner (1780-1849): concibió la idea de ordenarlos por triadas, grupos de tres elementos con propiedades similares y comparables. Posteriormente, a mediados del siglo XIX, el geólogo y mineralogista francés Alexandre-Émile Béguyer de Chancourtois clasificó por primera vez los elementos según su masa atómica. Para ello utilizó unos términos muy complicados, lo que hizo que su idea no tuviera mucho éxito. Además, no podemos olvidar que John Alexander Reina Newlands, químico analítico inglés, fue el primero en publicar una tabla periódica de los elementos. Utilizó para sustentar su hipótesis la ley de las octavas; una ley química que afirma lo siguiente: las propiedades químicas de los elementos se repiten cada 8 veces. Sin embargo, no fue ni un alemán, ni un francés, ni un inglés, quien concibiese la tabla periódica contemporánea. Hubo que esperar la llega de las teorías de un químico ruso.

Johann Wolfgang Döbereiner, primer científico en plantear una clasificación de elementos
Dmitri Ivánovich Mendeléyev: padre de la tabla periódica
Considerado el padre de la tabla periódica, Mendeléyev presentó en el año 1869 su idea de clasificación de elementos; algo inspirada en los antecedentes que ya existían y que he mencionado más arriba. La teoría de Mendeléyev determinaba los siguientes puntos:
- Las propiedades de los elementos son periódicas si se ordenan siguiendo su masa atómica.
- Los elementos que tienen propiedades similares, también tienen masas atómicas similares.
- La disposición de los elementos está vinculada a sus valencias (número de electrones que le faltan a un elemento para alcanzar su nivel máximo de energía).
- Los elementos comunes tienen, como norma, una masa atómica pequeña.
- La masa atómica es muy importante, ya que de ella depende el carácter del elemento.
- Más elementos serán añadidos a la tabla con el transcurso del tiempo.
- Podría ocurrir que la masa atómica de un elemento varíe.
- Las propiedades de un elemento se derivan de su masa atómica.
La tabla periódica de Mendeléyev tenía 63 elementos, y se fueron añadiendo elementos hasta que se alcanzó el número de 118 actuales.

Mendeléyev, padre de la tabla periódica contemporánea
Variación de la tabla periódica actual
La tabla periódica actual se ha remodelado y se basa en criterios algo diferentes a los de la tabla de Mendeléyev. Así, por ejemplo:
- Los elementos de la actual tabla periódica ya no se clasifican según su masa atómica, sino que ahora se clasifican por un número atómico creciente.
- En la misma columna colocamos los elementos que tienen en su capa exterior la misma cantidad de electrones. Un criterio que no se aleja del todo de la clasificación de Mendeléyev.
- La tabla periódica actual tiene 7 filas denominados periodos y 18 columnas que denominamos familias.
Presentación de la tabla periódica actual
Las últimas actualizaciones que se han llevado a cabo en la tabla periódica actual datan del año 2016, cuando la Unión Internacional de Química Pura y Aplicada (IUPAC), que representa la autoridad reconocida para determinar las reglas y nomenclaturas de los elementos fijó algunas nuevas características de la tabla periódica.
Desde la revisión del 2016, la tabla periódica cuenta con 118 elementos, de los que 83 son lo que denominamos «primordiales». Además, los últimos 24 elementos de la tabla son elementos denominados «sintéticos», ya que no existen en nuestro planeta y han sido creados por el hombre. Elementos algunos que se podrían llegar a encontrar en explosiones de supernovas.
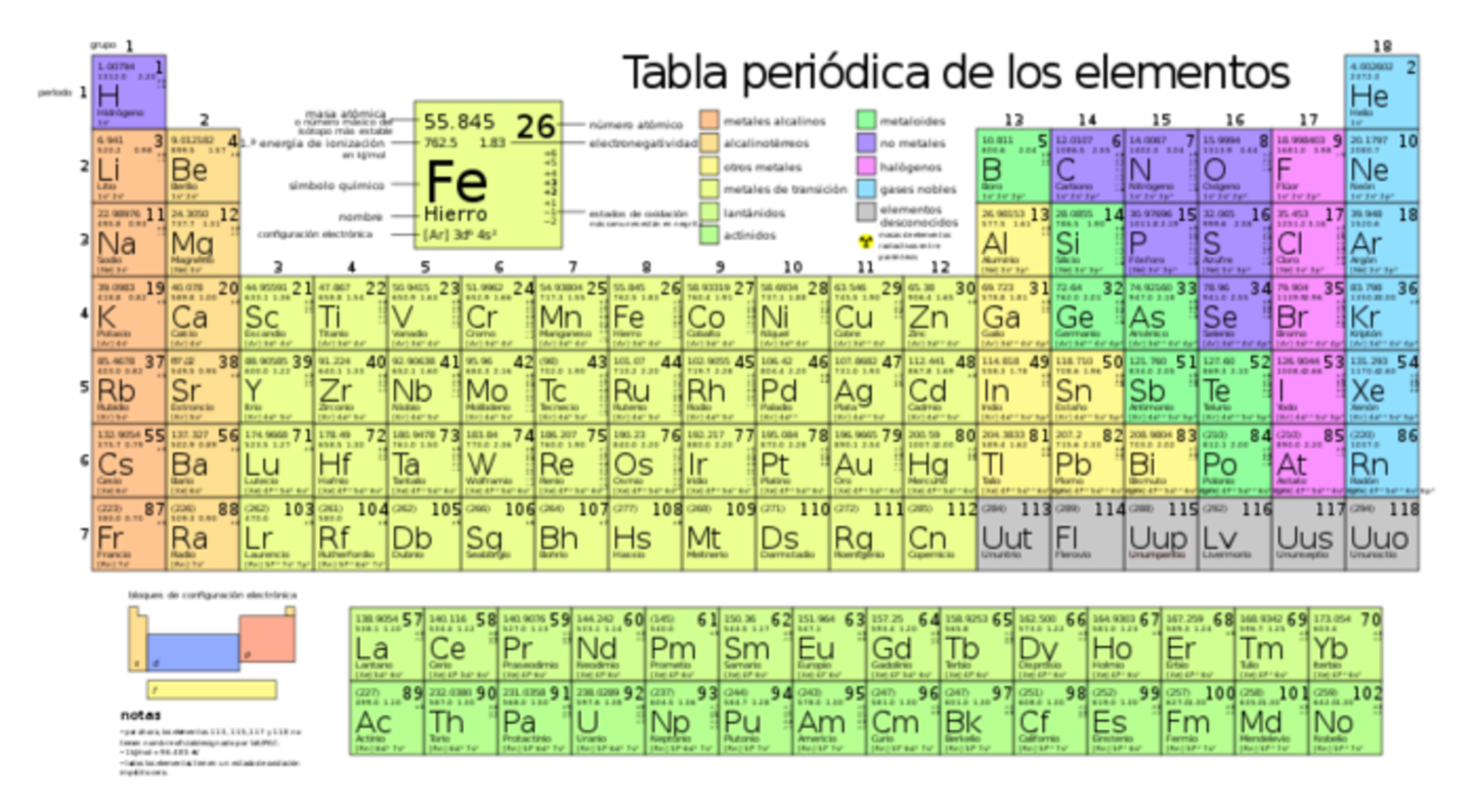
En este ejemplo podemos ver la clasificación en grupos y familias de elementos
Familias de elementos de la tabla periódica
En la clasificación actual de la tabla periódica, todos los elementos de una misma familia tienen el mismo número de electrones en su capa exterior, lo que hace de ellos elementos químicos con características similares. Es decir, reaccionan con el mismo tipo de compuesto, y, además, forman moléculas e iones comparables. Existen varias familias, veamos algunas de las más importantes.
Familia de los metales alcalinos
En esta familia se incluye el litio, el sodio, el potasio, el rubidio, el cesio y el francio. Todos estos elementos tienen una capa exterior con un electrón, y todos forman cationes al perder un electrón. Se trata de metales brillantes, blandos y muy reactivos. Es precisamente debido a su alta reactividad, que estos metales deben ser conservados en aceite mineral, por lo que no se encuentran tal cual en la naturaleza. De entre todos, el sodio es el metal alcalino más común en la naturaleza.
Familia de los metales alcalinotérreos
Esta familia incluye metales como el berilio, el magnesio, el calcio, el estroncio, el bario y el radio. Todos estos elementos tienen 2 electrones en su capa externa y, además, todos ellos forman cationes al perder dos electrones Los metales alcalinotérreos cuentan con un brillo plateado característico, y su denominación proviene de la palabra tierra, en referencia a la característica particular de que estos metales pueden resistir al fuego.

Ejemplo de un pedazo de magnesio
Familia de los lantánidos
Formada por 15 elementos, su nombre «lantánido» proviene del primero de todos los elementos que componen esta familia: el lantánido. Se trata de metales brillantes, capaces de empañarse rápidamente al aire libre y reacción con rapidez en contacto con el agua. Una familia de elementos que incluye algunos de los más relevantes, como por ejemplo el lantano, el cerio, el gadolinio o el terbio.
Familia de los actínidos
Una familia de elementos que cuenta con 15 elementos, metales pesados que toman su nombre del material primario de la familia: el actinio. Los actínidos son todos metales muy radiactivos, además de ser blandos y con reflejos plateados. En este sentido, podemos citar el uranio, el plutonio o el torio.
Familia de los metales de transición
La familia de los metales de transición es una familia que incluye muchos elementos de configuración electrónica particular. Esto es así porque son elementos que tienen una gran variedad de colores y, además, grandes conductores de electricidad. En esta familia se incluyen metales como el rodio, el paladio, el cobre, el platino y el titanio.

El cobre es uno de los metales de transición más utilizados del mundo
Familia de los metales pobres
La familia de los metales pobres cuenta con metales blandos o quebradizos que tienden a formar enlaces covalentes. Algunos ejemplos que encontramos en esta familia son el aluminio, el zinc, el estaño, el mercurio o el plomo.
Familia de los metaloides
La familia de los metaloides es una familia de elementos que cuentan con características muy particulares. Parecen metales, pero en realidad son frágiles y no son capaces de conducir la electricidad. Entre estos metaloides encontramos el boro, el silicio, el arsénico o el antimonio.
Familia de los no metales
La familia de los no metales es una familia de elementos que resultan ser excelentes aislantes, tanto térmicos, como eléctricos. Los no metales representan elementos muy necesarios para planetas donde puede haber vida, como por ejemplo la Tierra. Entre ellos encontramos el carbono, el nitrógeno, el oxígeno, el azufre, o el cloro.

El azufre es muy utilizado en la fabricación de ácido sulfúrico: explosivos, jabones, detergentes, pinturas o plásticos
Familia de los halógenos
La penúltima familia de elementos es la de los halógenos, que incluye elementos como el flúor, el cloro, el bromo, el yodo y el astato. A todos estos elementos les falta un electrón para completar su última capa.
Familia de los gases nobles
La última familia corresponde a la de los gases nobles. Estos gases también son conocidos como gases inertes monoatómicos e incluye algunos de los gases más importantes del universo: el helio, el neón, el argón, el Kriptón, el xenón y el radón. Todos ellos tienen una capa exterior completa que los hace poco reactivos, ya que no son capaces de formar iones, ni de participar en ninguna molécula.
¿Quién es el creador de la tabla periódica?
La tabla periódica contemporánea fue ideada y estructurada por el químico ruso Dmitri Ivánovich Mendeléyev.